Acides et bases de Lewis

Un acide de Lewis est une espèce chimique qui contient une orbitale électronique vide qui est capable d'accepter une paire d'électrons d'une base de Lewis pour former un adduit de Lewis. Une base de Lewis est donc toute espèce qui a une orbitale remplie contenant une paire d'électrons qui n'est pas impliquée dans la liaison mais qui peut former une liaison covalente de coordination (aussi appelée liaison dative) avec un acide de Lewis pour former un adduit de Lewis.
Par exemple, NH3 est une base de Lewis car il peut donner son doublet non liant d'électrons. Un autre acide de Lewis est le triméthylborane (Me3B) qui est capable d'accepter un doublet non liant. Dans un adduit de Lewis, l'acide et la base de Lewis partagent une paire d'électrons fournie par la base de Lewis, formant une liaison dative[1]. Dans le cadre d'une réaction chimique spécifique entre NH3 et Me3B, le doublet non liant de NH3 formera une liaison covalente de coordination avec l'orbitale vide de Me3B pour former l'adduit NH3•Me3B. La terminologie fait référence aux contributions de Gilbert N. Lewis[2].
Les termes nucléophile et électrophile correspondent plus ou moins à la base de Lewis et à l'acide de Lewis respectivement. Cependant, ces termes, en particulier leur nom abstrait que sont la nucléophilicité et l'électrophilicité, soulignent l'aspect cinétique de la réactivité, tandis que la basicité de Lewis et l'acidité de Lewis soulignent l'aspect thermodynamique de la formation d'adduits de Lewis[3].
Représentation des adduits
[modifier | modifier le code]Dans de nombreux cas, l'interaction entre la base de Lewis et l'acide de Lewis dans un complexe est indiquée par une flèche allant de la base de Lewis vers l'acide de Lewis en utilisant la notation d'une liaison covalente de coordination - par exemple, Me3B←NH3. Certaines sources indiquent la base de Lewis avec une paire de points (les électrons explicites étant donnés), ce qui permet une représentation cohérente de la transition de la base au complexe avec l'acide:
- Me3B + :NH3 → Me3B:NH3
Un point au centre peut également être utilisé pour représenter un adduit de Lewis, tel que Me3B•NH3. Un autre exemple est le diéthyléthérate de trifluorure de bore, BF3•Et2O. (Dans un usage légèrement différent, le point au centre est également utilisé pour représenter la coordination des hydrates dans divers cristaux, comme dans MgSO4•7H2O pour le sulfate de magnésium hydraté, que l'eau forme ou non une liaison covalente de coordination avec le métal.)
Bien qu'il y ait eu des tentatives d'utilisation des critères énergétiques informatiques et expérimentaux pour distinguer les liaisons datives des liaisons covalentes non-datives[4], cette distinction ne fait que montrer la source de la paire d'électrons. Les liaisons datives, une fois formées, se comportent simplement comme les autres liaisons covalentes, bien qu'elles aient généralement un caractère polaire considérable. De plus, dans certains cas (par exemple les sulfoxydes et les oxydes d'amine comme R2S → O et R3N → O), l'utilisation de la flèche de liaison dative est juste une commodité de notation pour éviter le dessin de charges formelles. En général, cependant, la liaison donneur-accepteur est simplement considérée comme quelque part le long d'un continuum entre le liaison covalente idéalisée et la liaison ionique[5].
Exemples
[modifier | modifier le code]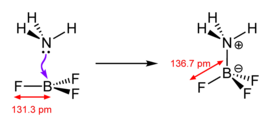
En général, l'expression « acide de Lewis » est limitée à des espèces trigonales planaires qui ont une orbitale p vide, tel que BR3 où R peut être un substituant organique ou un halogénure.[réf. nécessaire] Pour en citer d'autres, même des composés complexes tels que Et3Al2Cl3 et AlCl3 sont traités comme des acides de Lewis à géométrie trigonale planaire. Les ions métalliques tels que Na+, Mg2+ et Ce3+, qui sont invariablement complexés à des ligands supplémentaires, sont souvent des sources de dérivés insaturés de manière coordonnée qui forment des adduits de Lewis lors de la réaction avec une base de Lewis.[réf. nécessaire] D'autres réactions pourraient simplement être appelées réactions "catalysées par l'acide". Certains composés, tels que H2O, sont à la fois des acides de Lewis et des bases de Lewis, car ils peuvent accepter ou donner une paire d'électrons selon la réaction.
Les acides de Lewis sont divers. Les plus simples sont ceux qui réagissent directement avec la base de Lewis. Mais les plus courants sont ceux qui subissent une réaction avant de former le produit d'addition.
- Des exemples d'acides de Lewis basés sur la définition générale de l'accepteur de paires d'électrons sont donnés ci-dessous:
- le proton (H+) et les composés acidesdes ions onium, tels que NH4+ et H3O+
- des cations de métaux de transition à haut degré d'oxydation, par exemple Fe3+ ;
- d'autres cations métalliques, tels que Li+ et Mg2+, souvent sous forme de leurs complexes aqueux ou éther,
- espèces trigonales planaires, telles que BF3 et les carbocations H3C +
- pentahalogénures de phosphore, d'arsenic et d'antimoine
- les systèmes π pauvres en électrons, tels que les énones et les tétracyanoéthylènes.
Là encore, la description d'un acide de Lewis est souvent utilisée de manière vague. Par exemple, en solution, les protons seuls n'existent pas.
Acides de Lewis simples
[modifier | modifier le code]Certains des exemples les plus étudiés de ces acides de Lewis sont les trihalogénures de bore et les organoboranes, mais d'autres composés présentent ce comportement:
- BF3 + F− → BF4−
Dans cet adduit, les quatre ligands fluorure sont équivalents.
- BF3 + OMe2 → BF3OMe2
Le BF4− et le BF3OMe2 sont tous les deux des produits d'addition formés à partir de la base de Lewis trifluorure de bore.
Dans de nombreux cas, les adduits violent la règle de l'octet, comme c'est le cas pour l'anion triiodure :
- I2 + I− → I3−
La variabilité des couleurs des solutions d'iode reflète les capacités variables du solvant à former des adduits avec l'acide de Lewis I2.
Dans certains cas, l'acide de Lewis est capable de lier deux bases de Lewis, un exemple célèbre étant la formation d'hexafluorosilicate:
- SiF4 + 2 F− → SiF62−
Acides de Lewis complexes
[modifier | modifier le code]La plupart des composés considérés comme des acides de Lewis nécessitent une étape d'activation avant la formation du produit d'addition avec la base de Lewis. Des cas bien connus sont les trihalogénures d'aluminium, qui sont largement considérés comme des acides de Lewis. Les trihalogénures d'aluminium, contrairement aux trihalogénures de bore, n'existent pas sous la forme AlX3, mais sous forme d'agrégats et de polymères qui doivent être dégradés par la base de Lewis[6]. Un cas plus simple est la formation d'adduits de borane. Le monomère BH3 n'existe pas de manière notable, donc les adduits de borane sont en fait générés par dégradation du diborane:
- B2H6 + 2 H− → 2 BH4−
Dans ce cas, un intermédiaire B2H7− peut être isolé.
De nombreux complexes métalliques servent d'acides de Lewis, mais généralement seulement après avoir dissocié une base de Lewis plus faiblement liée, qui souvent l'eau.
- [Mg(H2O)6 ]2+ + 6 NH3 → [Mg(NH3)6 ]2+ + 6 H2O
H+ comme acide de Lewis
[modifier | modifier le code]Le proton (H+) est l'un des acides de Lewis les plus puissants mais aussi l'un des plus complexes. Il est conventionnel d'ignorer le fait qu'un proton est fortement solvaté (lié au solvant). Avec cette simplification à l'esprit, les réactions acide-base peuvent être considérées comme la formation d'adduits:
- H+ + NH3 → NH4+
- H+ + OH− → H2O
Applications des acides de Lewis
[modifier | modifier le code]Un exemple typique d'un acide de Lewis en action est la réaction d'alkylation de Friedel–Crafts[5]. L'étape clé est l'acceptation par AlCl3 d'une paire isolée d'ions chlorure, formant AlCl4− et créant l'ion carbonium fortement acide, qui est donc un électrophile.
- RCl + AlCl3 → R+ + AlCl4−
Bases de Lewis
[modifier | modifier le code]Une base de Lewis est une espèce atomique ou moléculaire où l'orbitale moléculaire la plus haute occupée (HOMO) est hautement localisée. Les bases de Lewis typiques sont des amines classiques telles que l'ammoniac et les alkylamines. D'autres bases de Lewis courantes comprennent la pyridine et ses dérivés. Certaines des principales classes de bases de Lewis sont:
- les amines de formule NH3−xRx où R = alkyle ou aryle. La pyridine et ses dérivés sont liés à ceux-ci.
- les phosphines de formule PR3−xAx, où R = alkyle, A = aryle.
- les composés O, S, Se et Te à l'état d'oxydation -2, y compris l'eau, les éthers, les cétones.
Les bases de Lewis les plus courantes sont les anions. La force de basicité de Lewis est en corrélation avec le pKa de l'acide parent: les acides avec un pKa élevé donnent de bonnes bases de Lewis. Comme toujours, un acide faible a une base conjuguée plus forte.
- Des exemples de bases de Lewis basés sur la définition générale du donneur de paires d'électrons son donnés ci-dessous:
La force des bases de Lewis a été évaluée pour divers acides de Lewis, tels que I2, SbCl5 et BF3[7].
| Base de Lewis | Atome donneur | Enthalpie de complexation (kJ/mol) |
|---|---|---|
| Et3N | N | 135 |
| quinuclidine | N | 150 |
| pyridine | N | 128 |
| acétonitrile | N | 60 |
| Et2O | O | 78,8 |
| THF | O | 90,4 |
| acétone | O | 76,0 |
| EtOAc | O | 75,5 |
| DMA | O | 112 |
| DMSO | O | 105 |
| tétrahydrothiophène | S | 51,6 |
| triméthylphosphine | P | 97,3 |
Applications des bases de Lewis
[modifier | modifier le code]Presque tous les donneurs de paires d'électrons qui forment des composés en se liant à des éléments de transition peuvent être considérés comme des ligands. Ainsi, une large application des bases de Lewis consiste à modifier l'activité et la sélectivité des catalyseurs métalliques. Les bases chirales de Lewis confèrent ainsi une chiralité à un catalyseur, permettant une catalyse asymétrique, utile pour la production de produits pharmaceutiques notamment.
De nombreuses bases de Lewis sont «multidentates», c'est-à-dire qu'elles peuvent former plusieurs liaisons avec l'acide de Lewis. Ces bases de Lewis multidentates sont appelées agents chélateurs.
Classification dure et molle
[modifier | modifier le code]Les acides et bases de Lewis sont généralement classés en fonction de leur dureté ou de leur mollesse. Dans ce contexte, dur caractérise des atomes petits et non polarisables et mou caractérise des atomes plus gros qui sont davantage polarisables.
- acides durs typiques: H+, cations de métaux alcalins/alcalino-terreux, boranes, Zn2+
- acides mous typiques: Ag+, Mo(0), Ni(0), Pt 2+
- bases dures typiques: ammoniac et amines, eau, carboxylates, fluorure, chlorure
- bases molles typiques: organophosphines, thioéthers, monoxyde de carbone, iodure
Par exemple, une amine va déplacer la phosphine à partir du produit d'addition avec l'acide BF3. De la même manière, les bases pourraient être classées. Par exemple, les bases donnant un doublet non liant à partir d'un atome d'oxygène sont plus dures que les bases donnant leur paire via un atome d'azote. Bien que la classification n'ait jamais été quantifiée, elle s'est avérée très utile pour prédire la force de la formation d'adduits, en utilisant les concepts clés selon lesquels les interactions acide dur - base dure et acide mou - base mou sont plus fortes que celles entre acide dur - base molle ou acide mou - base dure. Une étude ultérieure de la thermodynamique de l'interaction a suggéré que les interactions dures-dures sont favorisées par enthalpie, alors que les molles-molles sont favorisées par l'entropie.
Quantifier l'acidité de Lewis
[modifier | modifier le code]De nombreuses méthodes ont été conçues pour évaluer et prédire l'acidité de Lewis. Beaucoup sont basées sur des données spectroscopiques telles que les décalages de signaux RMN ou les bandes IR, par exemple la méthode de Gutmann-Beckett et la méthode Childs [8].
Le modèle ECW est un modèle quantitatif qui décrit et prédit la force des interactions acide-base de Lewis, −ΔH. Le modèle attribuait des paramètres E et C à de nombreux acides et bases de Lewis. Chaque acide est caractérisé par une contribution électrostatique notée EA et une contribution covalente notée CA des forces de liaisons. Chaque base est également caractérisée par ses propres EB et CB. L'équation est la suivante:
- −ΔH = EAEB + CACB + W
Le terme W représente une contribution d'énergie constante pour une réaction acide-base telle que le clivage d'un acide dimère ou d'une base. L'équation prédit l'inversion des acides et les forces des bases. Les présentations graphiques de l'équation montrent qu'il n'y a pas d'ordre unique des forces des bases de Lewis ou des forces d'acides de Lewis[9],[10] et que les échelles de propriété unique sont limitées à une gamme plus petite d'acides ou de bases.
Le concept est né avec Gilbert N. Lewis qui a étudié les liaisons chimiques. En 1923, Lewis a écrit Une substance acide est une substance qui peut employer un doublet d'électrons non liant d'une autre molécule pour compléter le groupe stable d'un de ses propres atomes.[2],[11] La théorie acide-base de Brønsted–Lowry a été publiée la même année. Les deux théories sont distinctes mais complémentaires. Une base de Lewis est également une base de Brønsted–Lowry, cependant un acide de Lewis n'a pas besoin d'être un acide de Brønsted–Lowry. La classification en acides et bases durs et mous (théorie HSAB) est apparue en 1963. La force des interactions acide-base de Lewis, telle que mesurée par l'enthalpie standard de formation d'un adduit, peut être prédite par l'équation à deux paramètres de Drago–Wayland.
Reformulation de la théorie de Lewis
[modifier | modifier le code]Lewis avait suggéré en 1916 que deux atomes sont maintenus ensemble dans une liaison chimique en partageant une paire d'électrons[12]. Lorsque chaque atome apporte un électron à la liaison, cela s'appelle une liaison covalente. Lorsque les deux électrons proviennent de l'un des atomes, cela s'appelle une liaison covalente dative ou liaison coordonnée. La distinction n'est pas très nette. Par exemple, lors de la formation d'un ion ammonium à partir d'ammoniac et d'hydrogène, la molécule d'ammoniac donne une paire d'électrons au proton. Néanmoins, Lewis a suggéré qu'un donneur de paires d'électrons soit classé comme une base et un accepteur de paires d'électrons soit classé comme acide.
Une définition plus moderne d'un acide de Lewis est une espèce atomique ou moléculaire avec une orbitale atomique ou moléculaire vide de faible énergie. Cette orbitale moléculaire de plus basse énergie (LUMO) peut accueillir une paire d'électrons.
Comparaison avec la théorie de Brønsted–Lowry
[modifier | modifier le code]Une base de Lewis est souvent une base de Brønsted–Lowry car elle peut donner une paire d'électrons à H+[13]; le proton est un acide de Lewis car il peut accepter une paire d'électrons. La base conjuguée d'un acide Brønsted-Lowry est également une base de Lewis car la déprotonation de l'acide laisse les électrons qui ont été utilisés pour la liaison A-H sous forme de doublet non liant sur la base conjuguée. Cependant, une base de Lewis peut être très difficile à protoner, tout en réagissant toujours avec un acide de Lewis. Par exemple, le monoxyde de carbone est une base de Brønsted–Lowry très faible mais il forme un adduit fort avec le BF3.
Dans une autre comparaison de l'acidité de Lewis et Brønsted–Lowry effectuée par Brown et Kanner[14], 2,6-di-t-butylpyridine réagit pour former le sel chlorhydrate avec HCl mais ne réagit pas avec BF3. Cet exemple démontre que les facteurs stériques, en plus des facteurs de configuration électronique, jouent un rôle dans la détermination de la force de l'interaction entre la di-t-butylpyridine volumineuse et le proton de petite taille.
Références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lewis acids and bases » (voir la liste des auteurs).
- IUPAC Gold Book − Lewis acid
- Gilbert Newton Lewis, Valence and the Structure of Atoms and Molecules, New York, New York, U.S.A., Chemical Catalog Company, (lire en ligne), p. 142 From p. 142: "We are inclined to think of substances as possessing acid or basic properties, without having a particular solvent in mind. It seems to me that with complete generality we may say that a basic substance is one which has a lone pair of electrons which may be used to complete the stable group of another atom, and that an acid substance is one which can employ a lone pair from another molecule in completing the stable group of one of its own atoms. In other words, the basic substance furnishes a pair of electrons for a chemical bond, the acid substance accepts such a pair."
- Anslyn, Eric V. 1960-, Modern physical organic chemistry, Sausalito, CA, University Science, (ISBN 1891389319, OCLC 55600610)
- Lepetit, Maraval, Canac et Chauvin, « On the nature of the dative bond: Coordination to metals and beyond. The carbon case », Coordination Chemistry Reviews, vol. 308, , p. 59–75 (DOI 10.1016/j.ccr.2015.07.018)
- March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. (ISBN 0-471-60180-2)
- Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. (ISBN 0-7506-3365-4).
- Christian Laurence and Jean-François Gal "Lewis Basicity and Affinity Scales : Data and Measurement" Wiley, 2009. (ISBN 978-0-470-74957-9)
- Childs, Mulholland et Nixon, « Lewis acid adducts of α,β-unsaturated carbonyl and nitrile compounds. A nuclear magnetic resonance study », Can. J. Chem., vol. 60, no 6, , p. 801–808 (DOI 10.1139/v82-117)
- Vogel G. C.;Drago, R. S., « The ECW Model », Journal of Chemical Education, vol. 73, , p. 701–707 (DOI 10.1021/ed073p701, Bibcode 1996JChEd..73..701V)
- Cramer, R. E., and Bopp, T. T. (1977) The Great E & C Plot. A graphical display of the enthalpies of adduct formation for Lewis acids and bases. Journal of Chemical Education 54 612–613
- Miessler, L. M., Tar, D. A., (1991) p. 166 – Table of discoveries attributes the date of publication/release for the Lewis theory as 1923.
- Lewis, « The atom and the molecule », Journal of the American Chemical Society, vol. 38, no 4, , p. 762–785 (DOI 10.1021/ja02261a002, lire en ligne)
- Traditionally, but not precisely, H+ ions are referred as "protons". See (en) « hydron », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Brown HC and Kanner B. "Preparation and Reactions of 2,6-Di-t-butylpyridine and Related hindered Bases. A case of Steric Hindrance toward the Proton." J. Am. Chem. Soc. 88, 986 (1966)
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- W.B. Jensen, The Lewis acid-base concepts : an overview, New York, Wiley, (ISBN 0-471-03902-0)
- Hisashi Yamamoto, Lewis acid reagents : a practical approach, New York, Oxford University Press, (ISBN 0-19-850099-8)

